研究内容
「化学で生命システムを理解する」
脳機能に代表されるように、生命の複雑な機能は細胞の複雑な階層性およびネットワーク形成により構築されます。また、従来は1つの臓器が固有の機能を持っていると考えられてきましたが、臓器間でも機能連関していることが最近の研究から徐々に明らかにされつつあります。
私たちは「化学」を土台として、生命の複雑さを分子レベルで解明するための研究ツール開発および生命機能解明を行うことを目的としております。中でも、脳機能の解明は、記憶のメカニズム、精神疾患、神経変性疾患など、未だにブラックボックスとされている重要課題の解決に直接繋がると期待されます。

以下、私たちが現在進めている研究、およびこれまでに遂行してきた研究内容です。
1. 新たな化学遺伝学的手法の開発
適切に設計された有機小分子は、標的とするタンパク質の機能を調節できます。そのため、細胞・組織・生体機能を制御する方法として極めて有用であり、薬学・医学において不可欠な研究ツールです。一方で、医学および生物学研究においては、近年、狙った細胞の特定のタンパク質機能を人為的に制御する新たな方法論が求められています。その理由は、動物個体あるいは脳組織は複数の細胞種によって構成されますが、それぞれを単独に解析する従来の研究手法では「木を見て森を見ていない」状況であり、生命システムは理解できません。全体像を見るためには、組織中(理想的には動物個体)で特定細胞の機能を明らかにすることが必要です。しかしながら、有機小分子は拡散した場所すべてで作用するため、狙った細胞だけに投与することは困難です。
最近のゲノム編集技術に代表されるように、有機化学の発展と並行する形で、分子生物学および遺伝子工学は劇的な進歩を遂げてきています。実際に、コンディショナルノックインなど狙った細胞の特定のタンパク質機能を改変する技術も開発され、医学および生物学研究には不可欠な研究ツールです。しかし、決められたタイミングで制御できない、不可逆であるなど、遺伝子工学手法にも限界もあります。
そこで、私たちは、狙ったタイミングで可逆的にタンパク質機能を制御できる「化学的アプローチ」と、細胞特異的にタンパク質機能を改変しうる「遺伝子工学」を組み合わせた「化学遺伝学」手法を開発することにより、組織や動物個体におけるタンパク質機能を明らかにすることを目指しています。特に、脳においてこの方法論を適用することで、特定の細胞の標的タンパク質機能を人為的に制御できますので、記憶や精神疾患の解明において必須な方法論になると期待されます。

2. 生体機能を明らかにするための有機化学的なアプローチの開拓
近年の抗体医薬に代表されるように、タンパク質薬が着目されており、その市場は拡大しています。また、生物学的研究でも、抗体に対して蛍光色素を連結して標的タンパク質を可視化するのは一般的です。しかし、抗体は大きなタンパク質であり、組織に対する浸透性が低いなどの問題も存在します。
有機小分子は薬として用いられているように、生体あるいは組織浸透性が高いという特性があります。そのため、適切に分子デザインすることで、生体内で標的タンパク質に作用させることができます。作用させるだけでなく、蛍光色素を連結したり、あるいはタンパク質に対して反応させることで、タンパク質の可視化技術にも繋がります。そこで、私たちは、実際に生体で使える有機化学的なアプローチを開拓することにより、新たな薬の作用メカニズムの解明や、組織中でタンパク質を可視化する研究を行なっています。
また、有機小分子の分子特性あるいは反応性は、化合物の構造を変えることにより自在にコントロールできます。化合物の特性を変えて細胞内に投与することで、標的タンパク質に対する反応性を制御することができ、その特徴からタンパク質の細胞内機能を明らかにするケミカルバイオロジー研究も行っています。
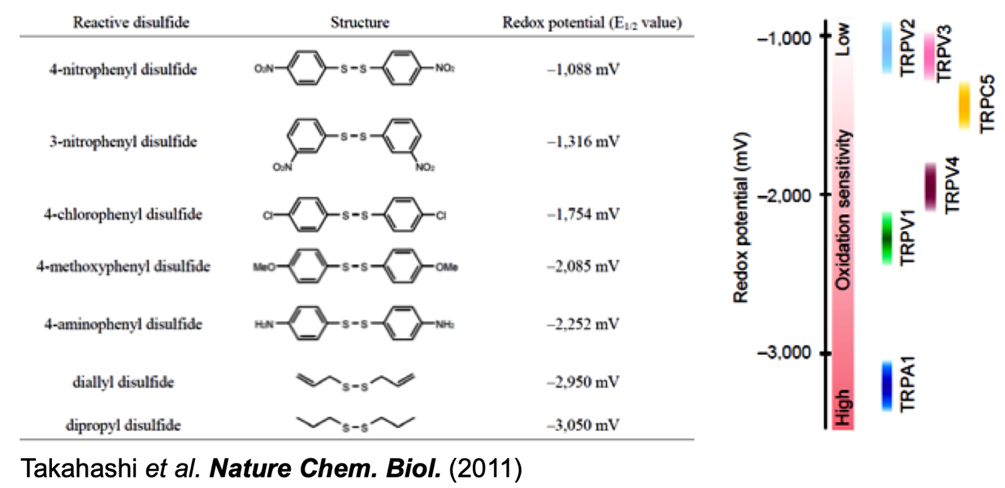
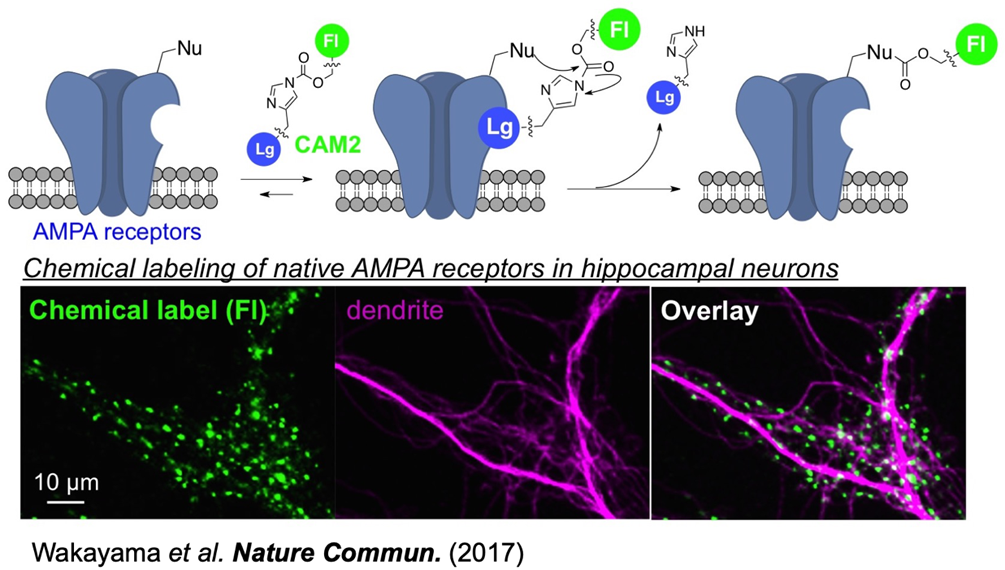
3. 細胞内局所で起こる細胞応答の同定・可視化およびその生理的意義の解明
細胞機能は小分子メッセンジャーの濃度、タンパク質の翻訳後修飾、膜電位などの物理化学的パラメーターなど、様々な要因の変化によって制御されていることが明らかになりました。その解明に大きく貢献した1つの方法が、バイオセンサーと呼ばれる、小分子の濃度変化などを可視化できるセンサーの開発です。
私たちは、これらの細胞内要因は細胞内に対して一様に起こるのではなく、局所的に起こっているのではないかと考えております。そこで、局所的に起こる細胞内イベントを明らかにするようなバイオセンサー、もしくは新たな方法論の開拓も進めております。
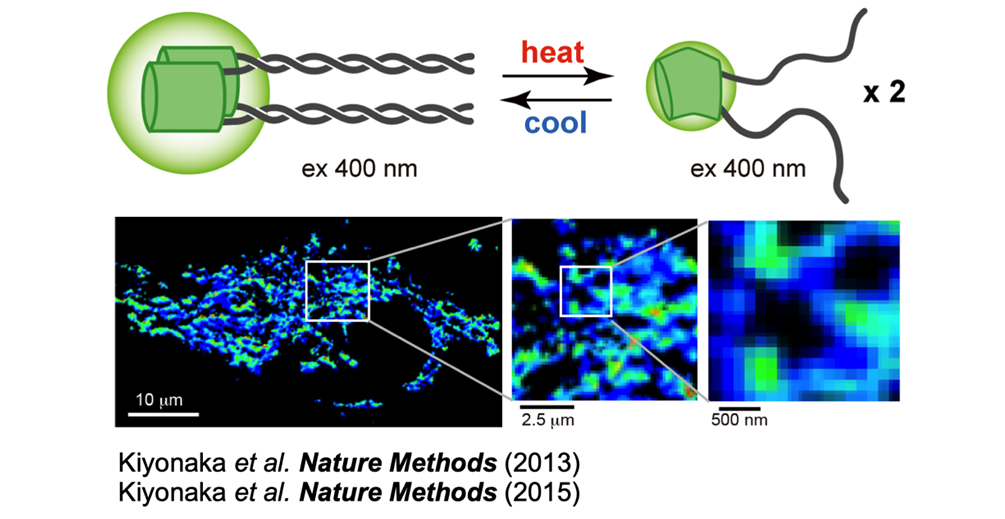
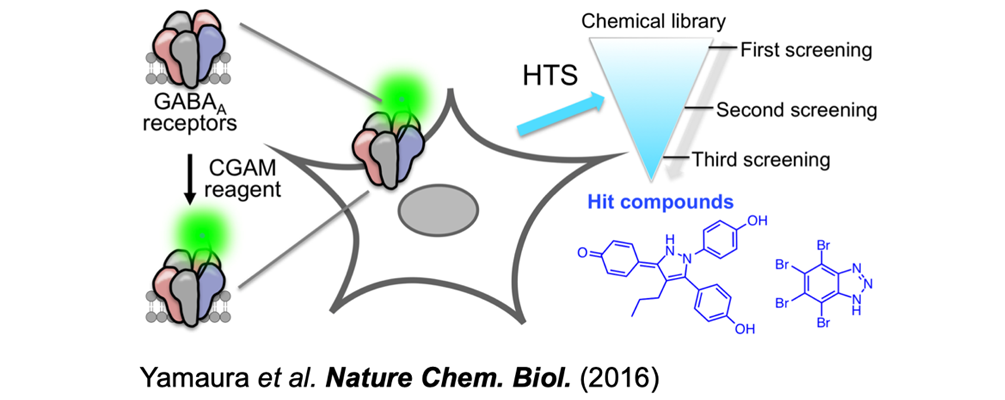
4. タンパク質翻訳後修飾による生体機能制御の解明
私たちの細胞の中では、転写・複製・修復など様々な生体反応が必要な時に必要な場所で起きています。この非常に精緻で秩序立った制御には、タンパク質間相互作用が大きく関わっています。タンパク質間相互作用は様々な翻訳後修飾により調節されており、私たちはその中で特にSUMO化修飾に着目しています。SUMO (Small ubiquitin-like modifier)はユビキチンによく似た構造を持つ低分子タンパク質で、細胞のストレス応答の際に大きく変動する翻訳後修飾の一つです。SUMO化されたタンパク質はSIM (SUMO interacting motif)を持つタンパク質と相互作用して、新たな分子ネットワークを形成します。
私たちは紫外線によるDNA損傷を認識し、結合するUV—DDBタンパク質の構成因子DDB2がDNA修復(ヌクレオチド除去修復)の際にSUMO化され、修復反応を促進する可能性を見出しました。このようなDNA修復機構をモデルとし、SUMO化による分子ネットワーク形成とその役割に関して解析を行なっています。
